LA CARTA D’IDENTITA’ DEGLI EMOCOMPONENTI:
La sicurezza del sangue è anche una questione di “etichetta”
In ambito trasfusionale, così come in quello alimentare, è la procedura che conferisce al “prodotto” i connotati per risalire alla provenienza e indicarne la ”singolarità”, permettendone così un’identificazione certa. Con l’etichetta si definisce il numero univoco della donazione, apposto sulle registrazioni di accettazione, sulle unità raccolte e sui campioni di laboratorio. Una etichettatura chiara, esaustiva e priva di elementi di fraintendimento consente:
– di seguire il percorso di ciascuna unità di sangue o di emocomponenti (raccolta, controllata, lavorata, conservata, rilasciata, distribuita e assegnata) dal donatore al ricevente e viceversa, ovvero assicura la tracciabilità o rintracciabilità.
– di ridurre notevolmente ogni rischio di errore di identificazione e ogni eventualità di scambio.
I servizi trasfusionali e le unità di raccolta adottano un codice di identificazione prelievo/unità come definito dalla corrispondente normativa UNI 10529 sull’etichettatura. Il sistema di etichettatura del sangue raccolto, degli emocomponenti intermedi e finali e dei campioni deve identificare, senza possibilità di errore, il tipo di contenuto e soddisfare le norme in materia di etichettatura e tracciabilità della vigente normativa italiana ed europea:
Legge 21 ottobre 2005, n. 219 “Nuova disciplina delle attività trasfusionali e della produzione nazionale degli emoderivati”.
Decreto del Ministro della Salute 3 marzo 2005, recante “Caratteristiche e modalità per la donazione del sangue e di emocomponenti”.
Decreto legislativo 9 novembre 2007 n. 207, recante “Attuazione della direttiva 2005/61/CE che applica la direttiva 2002/98/CE per quanto riguarda la prescrizione in tema di rintracciabilità del sangue e degli emocomponenti destinati a trasfusioni e la notifica di effetti indesiderati ed incidenti gravi”, ed in particolare gli articoli 2, 3 e 4, recanti rispettivamente “Rintracciabilità”, “Procedura di verifica per la consegna di sangue o di emocomponenti”, “Registrazione dei dati relativi alla rintracciabilità”.
Decreto legislativo 9 novembre 2007 n. 208, recante “Attuazione della direttiva 2005/62/CE che applica la direttiva 2002/98/CE per quanto riguarda le norme e le specifiche comunitarie relative ad un sistema di qualità per i servizi trasfusionali”, ed in particolare l’Allegato I: – articolo 4.2, che prevede che la scelta dei materiali, delle attrezzature e del sistema informativo è compiuta tenendo conto della necessità di ridurre al minimo i rischi per i donatori, per il personale e per gli emocomponenti, e migliorare l’efficacia, l’efficienza e l’uniformità delle attività dei servizi trasfusionali e delle unità di raccolta collegate; – articolo 6.3.5, che prevede la obbligatorietà della partecipazione a programmi di valutazione esterna di qualità dei test diagnostici effettuati; – articolo 6.5, che definisce le modalità di gestione della etichettatura degli emocomponenti; – articolo 6.6, concernente la validazione del sangue e degli emocomponenti.
Per quanto concerne l’etichettatura le Linee Guida CNS 01 Rev. 01 del 22 dicembre 2008 “Linee guida per l’adozione di misure di sicurezza nella gestione dei processi produttivi e diagnostici nei servizi trasfusionali” riportavano:
4) Tutti gli emocomponenti prodotti devono essere etichettati esclusivamente mediante etichette generate dai sistemi gestionali informatici con garanzia di associazione univoca fra donatore, unità, risultati analitici e, ove applicabile, bleeding lists.
5) Su tutti gli emocomponenti prodotti deve essere apposta l’etichetta di validazione e deve essere sistematicamente effettuato il controllo oggettivo informatizzato della corrispondenza univoca fra l’etichetta di prelievo e l’etichetta di validazione, tale da prevenire l’errata etichettatura finale delle unità di emocomponenti. I sistemi gestionali informatici devono essere dotati della funzione di blocco della assegnazione e del rilascio delle unità non sottoposte a tale controllo, da utilizzare sistematicamente.
6) Per quanto concerne le unità di plasma cedute all’industria, a partire dagli invii del mese di gennaio 2009 saranno escluse dalla lavorazione le unità di plasma mancanti di etichette generate come previsto al punto 4) e quelle prive di etichetta di validazione. Da tale data, inoltre, si raccomanda ai Servizi Trasfusionali che acquisiscono unità di emocomponenti in compensazione di non accettare unità che presentino le suddette non conformità.
A queste ultime hanno fatto seguito le più recenti Linee Guida CNS 04 Rev. 0 20 giugno 2014 “Linee Guida per l’adozione di ulteriori misure per la sicurezza del sangue e degli emocomponenti”:
4. A decorrere dal 1° gennaio 2015, i sistemi gestionali informatici in uso nelle Strutture trasfusionali generano, in fase di raccolta, per ogni unità di sangue intero e di emocomponenti, etichette con codice identificativo univoco conforme a quanto previsto dalla norma UNI 10529 per l’etichetta definitiva, con l’eccezione della lettera “I” (Italia), quale elemento di diversificazione dell’etichetta di prelievo da quella finale di validazione, da applicare in modo uniforme su tutto il territorio nazionale. Fermo restando che non è consentito sostituire in alcun modo l’etichetta di prelievo originaria, si conferma l’obbligatorietà della sistematica applicazione del controllo informatizzato della corrispondenza univoca fra le due etichette (barcode check). I sistemi gestionali informatici garantiscono la tracciabilità di questa operazione e bloccano le unità che non hanno superato tale controllo in qualsiasi fase di processo, con particolare riferimento all’assegnazione, consegna e distribuzione.
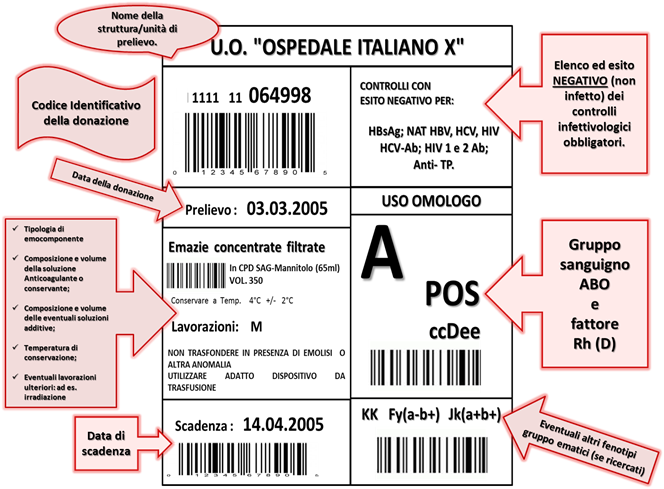
Quali dati deve contenere l’etichetta di un emocomponente destinato alla trasfusione di un paziente? (Allegato 3 – Decreto del Ministro della Salute 3 marzo 2005, recante “Caratteristiche e modalità per la donazione del sangue e di emocomponenti”).
Gli emocomponenti devono avere etichette conformi alle normative nazionali e internazionali. Devono essere leggibili a occhio nudo e con il lettore automatico e, salvo specifiche differenze per ogni singola tipologia di emocomponente, devono comprendere:
– contenuto della sacca (tipologia di emocomponente);
– gruppo sanguigno AB0 e fattore Rh;
– data di donazione e di scadenza;
– numero identificativo della donazione;
– nome e indirizzo della struttura;
– elenco ed esito negativo dei controlli infettivologici obbligatori (Virus dell’epatite B, HBV; Virus dell’ epatite C, HCV; AIDS: Human Immunodeficiency Virus, HIV; Sifilide: Treponema pallidum, TP).
– temperatura di conservazione;
– volume o peso netto;
– composizione e volume dell’anticoagulante e se presente della soluzione additiva;
– eventuali altri fenotipi gruppo-ematici (se ricercati);
– avvertenze per la conservazione e la trasfusione.
Come si presenta, dunque, una qualsiasi etichetta? (nell’esempio proposto si fa riferimento a Globuli Rossi Concentrati e Filtrati:
Dott. Giuseppe Marano, Medico Chirurgo, Specialista in Ematologia
