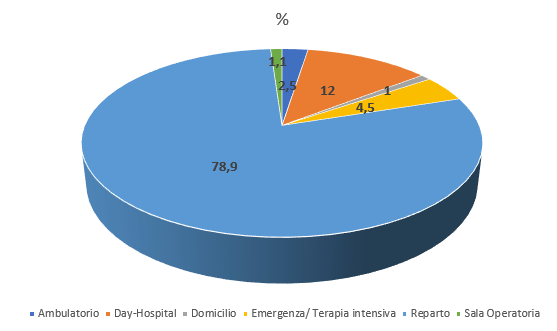
Gli effetti indesiderati gravi osservabili nei riceventi riconducibili alla qualità e alla sicurezza dei prodotti trasfusionali devono essere notificati dalle unità cliniche in cui vengono effettuate le terapie trasfusionali all’ST di riferimento, che a sua volta deve assolvere agli obblighi di notifica verso l’autorità regionale competente per territorio.
Il sistema nazionale di emovigilanza, in linea con quanto indicato dalla direttiva europea, classifica gli effetti indesiderati in:
- effetti indesiderati gravi sintomatici, cioè caratterizzati dalla comparsa di sintomi e segni clinici riconoscibili, che si verificano nel corso della trasfusione o in un breve periodo successivo a questa;
- effetti indesiderati gravi asintomatici o con sintomatologia tardiva, che comprendono le infezioni virali trasmesse dalla trasfusione;
- errori trasfusionali evitati o near miss
La possibilità di monitorare costantemente gli effetti indesiderati gravi della terapia trasfusionale sui riceventi e gli errori trasfusionali, anche se evitati, permette di tenere sotto controllo gli elementi di deviazione che possono intervenire anche nella migliore pratica trasfusionale e di stabilire azioni mirate per la definizione di misure correttive e preventive, oltre a costituire evidenze che possono riorientare le policy nazionali in termini di miglioramento della produzione degli emocomponenti e delle pratiche assistenziali associate alla trasfusione.